«У подагры клинический диагноз — врач может определить заболевание на основе типичных клинических проявлений. Дополнительно можно сдать биохимический анализ крови, чтобы увидеть повышенный уровень мочевой кислоты, хотя он определяется не у всех пациентов. К сожалению, у нас нет возможности использовать абсолютный диагностический принцип — пропунктировать сустав и с помощью поляризационного микроскопа обнаружить кристаллы мочевой кислоты. Поэтому основными показателями для выявления болезни по-прежнему являются клиника и повышенный уровень мочевой кислоты в крови. Любопытно, что во время приступа этот уровень может быть нормальным и даже сниженным, что неопытного врача вводит в заблуждение. Ее снижение в этот период вызывается выпадением мочевой кислоты в осадок, а затем ее уровень вновь повышается», — резюмирует доктор медицинских наук.
Не подорваться на подагре
Она хорошо изучена — еще Гиппократ в свое время называл ее «болезнью воскресного вечера и утра в понедельник» — но при этом весьма актуальна и для современного общества. Ее носителей называют милым словом «подагрики», но сама подагра по своей природе достаточно коварна и капризна. Правда, к счастью, вполне управляема. Как контролировать это хроническое заболевание, не позволять ему влиять на качество жизни пациента, Modus vivendi выяснял с помощью известного ревматолога и терапевта, доктора медицинских наук Николая СОРОКИ.
АКТУАЛИЗАЦИЯ
В появлении приступов подагры «виновата» мочевая кислота — она выпадает в осадок в суставах и вызывает артрит. Как отмечает Николай Сорока, подагра не сдает позиций и на сегодняшний день: «За последние 20 лет заболевание стало встречаться в 2 раза чаще. По Беларуси нет точной статистики, но в западных странах подагрический артрит диагностируется у 1-2% мужчин, а в Новой Зеландии цифра может доходить до 6%. Болезнь актуальна своим внезапным стартом: человек чувствует себя в норме, но затем неожиданно появляются боли в суставах, которые полностью обездвиживают пациента. Бытует мнение, что если сустав зажать в тисках до боли — по ощущениям это ревматизм, а если тиски крутануть еще раз — это подагра. Ее приступы выключают человека из активной жизни, и если пациент не лечится, он постепенно становится инвалидом».
«Взгляд на подагру за последние десятилетия принципиально изменился, — рассказывает врач-ревматолог. — Считается, что в 90% случаев возникновение подагры связано с проблемой в почках — нарушением транспорта мочевой кислоты на уровне специальных белков-транспортеров, и только у 10% пациентов имеются генетические дефекты других ферментов, участвующих в обмене мочевой кислоты в организме и влияющих на ее содержание в крови.
В последнее время заметно увеличилось количество пациентов с лекарственно-индуцированной подагрой, которая провоцируется приемом медпрепаратов для лечения других заболеваний. К ним в первую очередь относятся препараты, содержащие ацетилсалициловую кислоту, которые часто прописываются кардиологами, но надо учитывать, что ацетилсалициловая кислота блокирует выведение мочевой кислоты из организма, повышает ее содержание, провоцирует приступы подагры. Вторая группа нежелательных препаратов — мочегонные средства, которые входят в комбинированное лечение той же артериальной гипертензии.
СИМПТОМАТИКА
Подагрой значительно чаще болеют мужчины, поскольку женские половые гормоны (эстрогены) обладают защитным действием, снижая уровень мочевой кислоты в организме. До наступления менопаузы женщины страдают подагрическим артритом крайне редко.
«Болезнь обычно начинается ночью с очень сильных болей, отека, припухлости большого пальца ноги, — поясняет Николай Сорока. — В течение нескольких ночных часов боль заметно прогрессирует, становится невыносимой, а в целом первый приступ подагры длится 5-7 дней. Потом симптомы исчезают, и человек может полгода-год ничего не чувствовать, считая, что он абсолютно здоров. Но затем после провоцирующего фактора (общее переедание, употребление большого количества мясных продуктов, алкоголь, физическая перегрузка, стрессовая ситуация) у пациента вновь возникает подагрический артрит, после чего обычно и обращаются к врачу, который видит, что процесс серьезный и неслучайный. От подагры избавиться невозможно, но ее можно успешно контролировать».
ДИАГНОСТИКА
«У подагры клинический диагноз — врач может определить заболевание на основе типичных клинических проявлений. Дополнительно можно сдать биохимический анализ крови, чтобы увидеть повышенный уровень мочевой кислоты, хотя он определяется не у всех пациентов. К сожалению, у нас нет возможности использовать абсолютный диагностический принцип — пропунктировать сустав и с помощью поляризационного микроскопа обнаружить кристаллы мочевой кислоты. Поэтому основными показателями для выявления болезни по-прежнему являются клиника и повышенный уровень мочевой кислоты в крови. Любопытно, что во время приступа этот уровень может быть нормальным и даже сниженным, что неопытного врача вводит в заблуждение. Ее снижение в этот период вызывается выпадением мочевой кислоты в осадок, а затем ее уровень вновь повышается», — резюмирует доктор медицинских наук.
Николай Сорока разделяет лечение подагры на два медикаментозных этапа: «Для пациента самое главное — снять болевой синдром, для чего применяются нестероидные противовоспалительные препараты, способные прервать развитие приступа подагрического артрита. Некоторые из них оказывают действие в течение часа, полностью приступ может быть купирован за несколько дней. Назначение этих лекарственных средств отменяют сразу после прохождения болей — никаким целительным эффектом они не обладают.
Если пациент обращает внимание исключительно на боли, то для врача важно общее состояние человека, для чего проводится второй этап лечения, включающий прием препаратов, снижающих уровень мочевой кислоты в крови. Это существенно влияет на профилактику новых приступов заболевания, и если из-за каких-то стрессовых ситуаций или других факторов риска приступ подагры все-таки возникает, то, во-первых, он не бывает столь выраженным, а во-вторых, легко купируется современными противовоспалительными средствами».
ПРОФИЛАКТИКА
«Первичной профилактики (как не заболеть подагрой) не существует – давать всему населению препараты, снижающие уровень мочевой кислоты, нелогично, — иронизирует врач-ревматолог. — Поэтому существует только вторичная профилактика, предусматривающая ряд рекомендаций для предотвращения новых болевых приступов. Одна из основных — советы по соблюдению диеты, которые не так строги, как раньше. Важно ограничить потребление продуктов, содержащих пуриновые основания и фруктозу, которая, особенно в больших количествах, увеличивает уровень мочевой кислоты в крови. Сегодня сняты все ограничения на продукты с пуриновыми основаниями растительного происхождения — спаржа, чечевица, фасоль, бобы, помидоры и т.д. Диета для пациентов с подагрой — исключение из рациона морепродуктов, внутренних органов животных (потроха), сладких напитков с содержанием фруктозы. Желательно ограничить потребление мясных продуктов, в умеренном количестве разрешены чай и кофе. Нет ограничений на нежирные молочные продукты. А вот фруктовые соки, апельсины, мед, арбузы, содержащие фруктозу, не показаны или заметно ограничиваются. Из спиртных напитков для подагриков категорически запрещено пиво, в 2,5 раза увеличивающее риск развития заболевания; очень нежелательны виски, коньяк; водку можно потреблять очень умеренно, из менее крепких напитков наименее опасно сухое вино. Во всем надо знать меру, тогда значительно повышаются шансы для контроля болезни».
СПРАВКА Modus vivendi. Николай Сорока в 1972г. окончил Минский мединститут по специальности «лечебное дело». Доктор медицинских наук, профессор, заведующий 2-й кафедрой внутренних болезней БГМУ. Автор боле 450 научных работ, член редколлегий ряда белорусских и зарубежных специализированных медицинских журналов. Подготовил более 20 докторов и кандидатов медицинских наук.
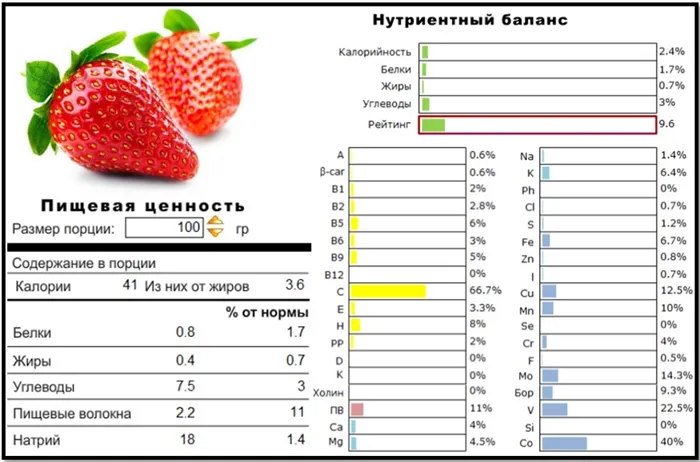
О чем свидетельствует повышенный уровень мочевой кислоты в крови?
Наступил сезон вспышек подагры. Как распознать болезнь? (17.01.2017.)

Празднество новогодних и рождественских праздников с богато накрытыми столами способствует вспышкам такого заболевания, как подагра. Чрезмерное употребление пищи у некоторых людей вызывает обострение заболевания, а у других симптомы подагры впервые проявляются сразу после праздников.
Симптомами подагры являются внезапные острые боли, нередко появляющиеся в ночное время, отечность, покраснение в одном из суставов, чаще всего в большом пальце ног, в основании пальцев рук или коленном суставе.
Подагра является одним из древнейших в истории мира заболеваний, упоминается в древнеегипетских рукописях старше 2 500 лет до нашей эры. Подагра является одним из наиболее изученных заболеваний, однако миф о ее неизлечимости по-прежнему существует.
Подагра излечима!
«Подагра является одной из редких форм артрита, которую возможно вылечить», -подчеркивает Анна Михайлова, ревматолог клиники «ОРТО», у которой в послепраздничное время, по обыкновению, существенно возросло число пациентов. Однако врач подчеркивает, несмотря на то, что симптомы подагры исчезают спустя несколько дней после вспышки, не стоит их игнорировать, а следует проконсультироваться с врачом. В редких случаях подагра ограничивается одной вспышкой. Если заболевание не лечить, оно может распространиться на новые суставы и ткани, повреждать их, а также по истечении времени сложнее поддаваться лечению.
«Для каждого пациента необходимо индивидуально подобрать наиболее эффективный комплекс методов лечения. Иногда даже нет необходимости в приеме лекарственных препаратов — гораздо более эффективных результатов можно достичь при помощи диеты и ежедневной физической активности», — заверяет ревматолог.
Каковы причины заболевания?
Если исторически подагра была болезнью богатых людей, то в последние десятилетия ревматологи пришли к выводу, что все чаще подагру вызывает привычка чрезмерного употребления пищи, лишний вес и малоподвижный образ жизни, также ставшие современным заболеванием.
Ожирение является наиболее распространенной, но не единственной причиной появления подагры. Вспышку заболевания может также может вызвать специфический чрезмерное характерный праздничному рацион — употребление мяса, рыбы, животной печени, а также подслащенных фруктовым сахаром напитков и алкоголя (продукты, содержащие пурин).
У мужчин по сравнению с женщинами подагра появляется раньше – в возрасте от 40-60 лет, в то время как у женщины — после 65 лет (после менопаузы).
Исследования показывают, что у тех людей, в семьях которых кровный родственник страдает от подагры, существует риск наследования данного заболевания.
О чем свидетельствует повышенный уровень мочевой кислоты в крови?
Ежедневно в крови человека в небольших количествах циркулирует мочевая кислота, являющаяся конечным продуктом обмена веществ. Обычно наш организм справляется с ее выведением через почки и мочевыделительные пути. Но когда этот процесс нарушен, в крови накапливается слишком высокая концентрация мочевой кислоты. Вспышку подагры провоцирует оседание в суставах кристаллов мочевой кислоты. Соприкосновение этих острых образований с нежными и чувствительными суставными тканями вызывает боль и воспаление.
Повышенное содержание мочевой кислоты в крови является характерным и может провоцировать появление не только появление подагры, но и многих других заболеваний, например, сердечно-сосудистых, почечных и даже сахарного диабета 2 типа Высокая концентрация мочевой кислоты способствует более стремительному и разрушительному течению этих заболеваний, а также появлению новых.
Связь между несколькими заболеваниями и количеством мочевой кислоты в крови была актуализирована и на посещенном в начале зимы др. Анной Михайловой международном симпозиуме «Мочевая кислота и кардиоваскулярные заболевания» в Болонье (Италия), побуждая коллег следить за здоровьем вышеупомянутых пациентов глубже и в более широком масштабе, чем принято.
К кому обращаться за помощью?
Подагру безошибочно диагностирует врач ревматолог, поэтому в случае, если у Вас появились подозрения, стоит искать помощи именно этого специалиста.
«Если вспышка подагры произошла впервые, скорее всего, можно обойтись без применения лекарств. Однако необходимо внести изменения в свой образ жизни. Если подагра уже на протяжении какого-то периода времени является вашим спутником, то в дополнение к необходимости изменить диету и физическую активность, нужно подобрать медикаменты, решающие специфические проблемы, т.е. снижающие боли в моменты обострения, способствующие выведению мочевой кислоты, снижающие ее образование или устраняющие вызванные подагрой осложнения, например, образование почечных камней. Подагра является излечимой болезнью, побуждающей людей меняться в лучшую сторону», — резюмирует Анна Михайлова.
Профилактика подагры:
- Ежедневно употреблять 2 л воды;
- Придерживаться разнообразного рациона;
- Кушать умеренно, чтобы утолить голод, не объедаться;
- Физическая активность должна стать неотъемлемой частью ваших будней;
- Отдельные исследования показывают, что кофе, витамин С и вишни снижают уровень мочевой кислоты в крови. Добавьте их в свой рацион, но помните об умеренном количестве.
В клинике «ОРТО» пациентов консультируют два ревматолога:
Запрещается принимать пищу за 8-12 часов до сдачи биоматериала;
Интерпретация результата
Повышение значений может наблюдаться при данных состояниях:
- Подагра;
- Онкологические заболевания;
- Почечная недостаточность;
- Диета с большим содержанием пуринов;
- Гипотиреоз;
- Псориаз.
Понижение значений может наблюдаться при данных состояниях
- Диета с низким содержанием пуринов;
- Алкоголизм;
- Нарушение активности ферментов;
- Прием аллопуринола;
- Болезнь Вильсона-Коновалова.
Результаты лабораторных исследований не являются единственным критерием, учитываемым лечащим врачом при постановке диагноза и назначении соответствующего лечения, и должны рассматриваться в комплексе с данными анамнеза и результатами других возможных обследований, включая инструментальные методы диагностики.
В медицинской компании «LabQuest» Вы можете получить персональную консультацию врача службы «Doctor Q» по результатам исследований во время приема или по телефону.
Одновременно с трудами И.И. Мечни кова и П. Эрлиха появились знаменитые пуб ликации Л. Пастера, который продемонстрировал эффективность системы специфического иммунитета, основанного на реакциях В- и Т-лимфоцитов. Демонстрация высокой эффективности вакцинации против различных инфекций произвела глубокое впечатление на современников, после чего все внимание специалистов, занимающихся воспалительными заболеваниями, было переключено на систему специфического иммунитета. Н.Ф. Гама лея под впечатлением работ Л. Пастера писал, что “… дни теории фагоцитоза И.И. Мечникова сочтены …”.
Концепция аутовоспаления в генезе подагры и гиперурикемии
В статье содержится обзор современных представлений о патогенезе и подходах к лечению подагры и гиперурикемии. Представлены данные, обосновывающие воспалительную природу осложнений гиперурикемии, в том числе артериальной гипертонии и метаболического синдрома. Обосновывается необходимость комплексного подхода к лечению подагры с включением не только методов снижения уровня мочевой кислоты в крови, но и подавления аутовоспалительных реакций. Изложенные положения проиллюстрированы на клиническом примере из собственной практики редкого случая АА-амилоидоза, осложнившего течение хронической подагры.
Подагра, проявляющаяся атаками ост рого артрита, – яркий пример воспалительного заболевания, характеризующегося выраженной экссудативной фазой, в развитии которой большое значение имеют нейтрофилы, макрофаги и другие клетки врожденного неспецифического иммунитета.
Воспаление является комплексной реакцией на различные патогены, развивается не только в зоне повреждения, но и сопровождается выраженной системной реакцией с целью максимального восстановления поврежденных тканей [1]. Упрощен ная формула воспалительной реакции включает 5 известных признаков, каждый из которых представляет собой проявление сосудистой реакции в зоне воспаления – гиперемия, припухлость, боль, локальное повышение температуры, нарушение функции. В то же время следует признать, что воспаление нельзя отождествлять с сосудистой реакцией. На это обратили внимание уже классики теории воспаления – И.И. Мечников и П. Эр лих
Поскольку сосудистая воспалительная ре ак ция формировалась у животных па раллельно развитию теплокровности, И.И. Мечников в своих публикациях задает читателю риторический вопрос: разве воспаление не существует у рыб и более низших животных, не обладающих теплокровностью? [2] Далее И.И. Мечников доказывает, что принципиальным и наиболее древним (уже у простейших) процессом, на основе которого развивается воспаление, является фагоцитоз. Мечниковской теории фагоцитоза П. Эрлих, разработавший метод цитологических окрасок, противопоставлял гипотезу о дегрануляции воспалительных клеток, которую он наблюдал в клетках миелоидного ряда. Синтез обеих теорий впоследствии позволил обосновать концепцию врожденного иммунитета, носителями которого являются различные фагоциты (нейтрофилы, макрофаги, дендритные клетки и др.).
Клетки врожденного иммунитета способны реагировать на групповые лиганды, специфичные для родственных микробов и поврежденных клеток организма. Система врожденного иммунитета в рамках физиологической реакции не реагирует на собственные антигены. Недостаточность врожденного иммунитета проявляется в отсутствии иммунологической памяти и ограниченном наборе генетически закрепленных реакций.
Одновременно с трудами И.И. Мечни кова и П. Эрлиха появились знаменитые пуб ликации Л. Пастера, который продемонстрировал эффективность системы специфического иммунитета, основанного на реакциях В- и Т-лимфоцитов. Демонстрация высокой эффективности вакцинации против различных инфекций произвела глубокое впечатление на современников, после чего все внимание специалистов, занимающихся воспалительными заболеваниями, было переключено на систему специфического иммунитета. Н.Ф. Гама лея под впечатлением работ Л. Пастера писал, что “… дни теории фагоцитоза И.И. Мечникова сочтены …”.
является достаточно поздним эволюционным приобретением и возникла только у млекопитающих. Главной новацией этой системы стало появление у лимфоцитов под влиянием антигенной стимуляции способности к реарранжировке генов, а возникшее в результате этого неограниченное число генетических вариаций позволило синтезировать индивидуальные антитела к любому антигену.
Эти открытия перевернули представления врачей о механизмах воспаления. В итоге в течение многих лет авторитетные руководства по патологии среди причин воспаления называли лишь три – инфекции, интоксикации и аутоиммунные процессы [3]. Под последними понимали развитие реакций против собственных антигенов, реализуемых главным образом аутореактивными Т-лимфоцитами и/или синтезом аутоантител В-лимфоцитами. Реакциям врожденного иммунитета придавали вспомогательное значение, считая их необходимыми лишь на этапе инициации воспаления и презентации антигена, в то время как специфическому иммунитету приписывали основное значение в развитии эффекторных реакций.
В последние два десятилетия отмечается повышение интереса к системе врожденного иммунитета в рамках новой теории аутовоспаления, под которым понимают самостоятельное развитие полноценных воспалительных реакций без участия Т и/или В-лимфоцитов, только за счет активации системы фагоцитов [4]. Чаще всего такие заболевания развиваются вследствие генетических мутаций. Таким образом, был объяснен патогенез ряда редких моногенных семейных периодических лихорадок: периодической болезни (мутации пирина), гипериммуноглобулинемии D (дефицит мевалонаткиназы), криопиринопатии (мутации криопирина у больных семейной холодовой крапивницей, синдромом Макла-Уэллса, NOMID-CINCA), TRAPS (мутации рецептора к фактору некроза опухоли альфа). В настоящее время таких моногенных аутовоспалительных заболеваний описано достаточно много. Несмотря на редкость этих состояний их изучение позволило открыть важнейший механизм аутовоспаления, реализуемый фагоцитами, в первую очередь, нейтрофилами – гиперсекрецию интерлейкина-1 вследствие формирования внутриклеточной макромолекулярной платформы – криопириновой инфламмасомы. Сборка инфламмасомы происходит в результате активации криопирина с последующим соединением с белками ASC, CARDINAL, каспазой-1. Основной функциональной задачей криопириновой инфламмасомы является активация каспазы-1, которая, в свою очередь, приводит к активации интерлейкина-1 [5].
Для криопиринопатий характерна спонтанная активация мутантного криопирина. При периодической болезни мутации пирина нарушают его способность контролировать сборку инфламмасомы, дефицит мевалонаткиназы приводит к недостаточной продукции изопреноидов, необходимых для фиксации инфламмасомы, и, вследствие этого, ее несвоевременной активации. Несмотря на то, что существуют и другие механизмы аутовоспаления, криопириновая инфламмасомопатия является одним из наиболее частых механизмов [5].
В дальнейшем выяснилось, что при многих ревматологических и, в целом, воспалительных заболеваниях внутренних органов возможно сочетание различных гетерозиготных мутаций, вовлекающих аутовоспалительные механизмы. Такие заболевания относят к группе полигенных аутовоспалительных болезней. Эта ситуация оказалась достаточно частой в практике врачей, что делает по настоящему актуальным выделение аутовоспаления как самостоятельного варианта воспалительных заболеваний. К подобным заболеваниям относятся, в первую очередь, серонегативные спондилоартропатии (анкилозирующий спондилоартрит, псориатическая артропатия, болезнь Крона, хронический язвенный колит, синдром Стилла), интерстициальные болезни легких (саркоидоз, пневмокониоз и др.) и многие другие [5].
Оказалось, что аутовоспаление не всегда развивается вследствие генетической предрасположенности, существуют модели исключительно приобретенного механизма аутовоспалительного заболевания. Примером такой приобретенной инфламмасомопатии является подагра. Сама гиперурикемия как предпосылка подагры может быть генетически обусловленной [6], однако аутовоспалительная подагрическая атака развивается как генетически нормальная реакция на гиперурикемию, не связанная с мутациями. В этом случае активация инфламмасомы связана с тем, что криопирин является внутриклеточным рецептором, который реагирует на различные патогены, в том числе кристаллические структуры (кристаллы мочевой кислоты, холестерина), оказавшиеся в кровотоке или интерстиции [5]. Поскольку растворимость мочевой кислоты при физиологическом рН составляет 6,8 мг/дл, то предел растворимости мочевой кислоты может быть достигнут уже при нормальной ее концентрации и повышении температуры тела. В этом случае возможна трансформация растворенной мочевой кислоты в кристаллическую форму, что запускает активацию инфламмасомы в нейтрофилах и провоцирует атаку подагры [6]. Важным фактором, сдерживающим неконтролируемую кристаллизацию мочевой кислоты, является то, что плазма, обладая свойствами коллоидного раствора, повышает растворимость мочевой кислоты, а некоторые ее компоненты ингибируют образование кристаллов. По этой причине даже при повышенном уровне мочевой кислоты в крови у многих пациентов подагра не развивается. Тем не менее, это не исключает возможность активации инфламмасомы фагоцитов у лиц с гиперурикемией даже вне подагрической атаки, что создает предпо сылки для персистирования субклинического аутовоспаления, являющегося важным фактором развития осложнений.
В течение последнего десятилетия было доказано, что гиперурикемия является независимым фактором риска артериальной гипертонии, фибрилляции предсердий и сердечно-сосудистых заболеваний, ассоциирована с сахарным диабетом, ожирением и хронической болезнью почек [7-12]. Это обосновывает правомочность включения гиперурикемии в состав метаболического синдрома и, следовательно, в группу факторов повышенного риска опасных сердечно-сосудистых осложнений [13].
Среди механизмов артериальной гипертонии у больных с гиперурикемией в первую очередь обсуждают блокаду продукции оксида азота [14-24], в результате чего снижается его системное вазодилатирующее действие, уменьшаются контроль пролиферативной активности гладких миоцитов стенок артерий и антитромбогенный эффект. Возникающее под влиянием этого повышение общего периферического сопротивления сосудов является мощным фактором активации ренин-ангиотензиновой системы с развитием артериальной гипертонии. Блокаду синтеза оксида азота у больных с гиперурикемией связывают с гиперпродукцией свободных перекисных радикалов, что, в свою очередь, обусловлено персистирующей субклинической активацией аутовоспалительных механизмов [14-24]. H. Zheng и соавт. в опытах на кроликах показали, что гиперурикемия с высокой достоверностью коррелировала с уровнем ренина и ангиотензина II, а назначение лозартана приводило не только к нормализации активности ренина и ангиотензина II, но также к подавлению пролиферации гладких миоцитов [24]. Важным фактором подавления пролиферативной активности гладких миоцитов сосудов является также снижение концентрации адипонектина, которое коррелирует с гиперурикемией [25,26].
Кристаллы мочевой кислоты способны непосредственно повреждать эндотелий сосудов, что приводит к субэндотелиальной депозиции липидов и развитию атеросклероза. В исследовании случай-контроль (n=4884) уровень мочевой кислоты коррелировал с кальцификацией коронарных артерий, индекс которой позволял четко выявлять пациентов, относящихся к группе высокого риска летального исхода [27]. По данным китайских исследователей, проанализировавших 6347 больных ишемической болезнью сердца, наличие гиперурикемии повышает риск коронарной болезни в 2,76 раза [28]. Этот эффект реализуется через воспалительную индукцию оксидативного стресса и повреждение эндотелия кристаллами мочевой кислоты [28]. С гиперпродукцей воспалительных цитокинов, оксидативным стрессом M. Kuwabara и соавт. связывают и повышенный риск фибрилляции предсердий у больных с гиперурикемией [29,30].
Ассоциация гиперурикемии с инсулинрезистентностью и нарушениями обмена углеводов также может объясняться действием свободных перекисных радикалов, продуктов оксидативного стресса активированных нейтрофилов, блокадой продукции оксида азота, активацией криопириновой инфламмасомы в самих бетаклетках островков Лангерганса с их последующим апоптозом. Сходные процессы наблюдают также в гепатоцитах что приводит к жировой дистрофии печени [31,32].
Таким образом, в настоящее время сопутствующие гиперурикемии состояния хорошо обоснованы. Име ют ся достаточные причины предполагать, что они во многом обусловлены хронической субклинической воспалительной активностью, патогенез которой объясняют аутовоспалительной инфламмасомопатией, сопровождающейся гиперпродукцией интерлейкина-1. В этой связи одним из основных способов предотвращения артериальной гипертонии и атеросклероза у больных с гиперурикемией и подагрой является проведение длительной противовоспалительной терапии с обязательным подавлением активности интерлейкина1.
В лечении инфламмасомопатий, в том числе полигенных, таких как синдром Стилла, высокой эффективностью обладают ингибиторы интерлейкина-1, в особенности канакинумаб, оказывающий пролонгированное действие. При подагре также имеется опыт применения этого препарата. Среди пациентов с противопоказаниями, непереносимостью или резистентностью к традиционным нестероидным противовоспалительным средствам или колхицину проведено два многоцентровых контролируемых рандомизированных исследования, которые показали высокую эффективность канакинумаба в предотвращении приступов подагры [32-34].
Рекомендованная доза препарата у взрослых составляет 150 мг, препарат вводят однократно подкожно во время приступа подагрического артрита. Для достижения максимального эффекта канакинумаб необходимо вводить как можно раньше после начала приступа подагрического артрита. У пациентов с положительным ответом на терапию препаратом при необходимости продолжения лечения повторное введение канакинумаба возможно не ранее чем через 12 недель после предыдущей инъекции. Оптимизацию контроля гиперурикемии следует проводить с помощью соответствующих противоподагрических препаратов.
В редких случаях у больных, способных синтезировать амилоидогенный вариант белка острой фазы воспаления SAA, подагра может осложниться вторичным АА-амилоидозом. Такое осложнение может свидетельствовать о том, что у пациента даже вне приступа подагры сохраняется высокая острофазовая субклиническая активность. Однако скорее можно ожидать, что течение подагры у этих пациентов будет характеризоваться тяжелым многосуставным поражением с развитием деформаций и многочисленных тофусов. Един ственным способом остановить прогрессирование амилоидоза у таких пациентов является длительное многолетнее лечение ингибитором интерлейкина-1. Приводим такое наблюдение из собственной практики.
Больной Т., 66 лет, в течение многих лет страдает артериальной гипертонией 3 степени, регулярно антигипертензивные средства не принимает. Шесть лет назад впервые развился острый артрит левого голеностопного сустава, диагностирована подагра. В дальнейшем к врачам не обращался, периодически повторялись острые приступы артрита, преимущественно поражались крупные суставы ног, однако неоднократно вовлекались и суставы рук, в том числе мелкие, нередко развивался олигоартрит. Самостоятельно принимал диклофенак. Год назад участились приступы до 2-3 раз в месяц, отметил ограничение подвижности кистей. При рентгенографии кистей и ультразвуковом исследовании выявлены признаки хронической тофусной подагры. В крови сохранялся высокий уровень мочевой кислоты в крови (650-700 мкмоль/л). Назначен колхицин 1 мг/сут.
В связи с выявленной протеинурией 8-12 г/сут и снижением фильтрационной функции почек (сывороточный креатинин 129,4 мкмоль/л, скорость клубочковой фильтрации 47,4 мл/мин) проведена биопсия почки. На фоне диффузного глобального гломерулосклероза пре имуществнно по ходу сосудов почек выявлены конгофильные массы, обладающие свойством двойного лучепреломления в поляризованном свете. Диагно сти рован амилоидоз. Отсутствие моноклональной гамма патии по результатам иммунохимического иссле до вания с применением высокочувствительных методов исключало AL-тип амилоидоза. Нефропати ческий вариант амилоидоза, высокие уровни С-реактивного белка (35 мг/л) и наличие хронического подагрического полиартрита позволили диагностировать АА-амилоидоз. Проведено тщательное обследование для исключения паранеопластической природы амилоидоза – эзофагогастродуоденоскопия, колоноскопия, мультиспиральная компьютерная томография органов грудной клетки и брюшной полости.
К лечению колхицином 1 мг/сут добавлен канакинумаб 150 мг, возобновлено лечение аллопуринолом 100 мг/сут. Через год после начала лечения канакинумабом купирован нефротический синдром, протеинурия снизилась до 0,67-1,4 г/л, функция почек не ухудшилась. Приступы подагры не повторялись, нормализовался уровень С-реактивного белка, улучшилась подвижность в суставах кистей, заметно уменьшился в размерах тофус в области левого запястья.
Представленное наблюдение демонстрирует современные возможности эффективного лечения АА-амилоидоза. Применение канакинумаба позволило не только купировать нефротический синдром, но и задержать прогрессирующее ухудшение функции почек, которое потребовало бы назначения почечной заместительной терапии. Пожалуй, наиболее приемлемой схемой для длительной терапии следует признать колхицин 1-2 мг/сут, при неэффективности которого следует обсуждать необходимость назначения канакинумаба.
Представленное наблюдение показывает также необ ходимость комплексной терапии у больных подагрой. Только противовоспалительное лечение эффективно снижает риск повторных подагрических атак, однако не дает возможность остановить прогрессирование – у пациентов может усугубиться эрозивная артропатия, продолжиться рост тофусов, что, в итоге, способствует ухудшению функции суставов. Поэтому лечение больного подагрой и гиперурикемией обязательно должно включать мероприятия по снижению уровня мочевой кислоты в крови и тканях [6].
Традиционным способом снижения уровня мочевой кислоты в крови является соблюдение гипопуриновой диеты, так как мочевая кислота является продуктом метаболизма пуриновых оснований. Однако соблюдение низкопуриновой диеты в большинстве случаев не является достаточным для достижения целевого уровня мочевой кислоты, поэтому проведение адекватной лекарственной терапии – основа успеха лечения заболевания [35]. Трудность соблюдения диеты связана со значительным изменением образа жизни – отказом от алкоголя, резким ограничением базовых продуктов питания (мясо), что является неприемлемым для людей с гедонистическим складом личности. Не менее важной причиной недостаточной эффективности диеты является также то, что баланс поступления и выведения мочевой кислоты в первую очередь обусловлен ограничениями в экскреции мочевой кислоты почками (две трети экскретируемой мочевой кислоты выводится почками и одна треть – желудочно-кишечным трактом). Известно, что гиперурикемия развивается после длительного периода повышенной экскреции мочевой кислоты с мочой и является результатом декомпенсации механизмов ее выведения, что многими исследователями рассматривается как проявление почечной недостаточности. Во всяком случае любое выявление гиперурикемии следует рассматривать как возможный признак хронического уратного интерстициального нефрита.
Нормальная урикозурия составляет 620±75 мг/сут (нормальный клиренс 8,7±2,5 мл/мин, нормальная экскретируемая фракция мочевой кислоты 7,25±2,98%, или 6-8%), 91-95% профильтровавшейся мочевой кислоты подвергается реабсорбции в обмен на внутриклеточные анионы, наблюдается также небольшая тубулярная секреция мочевой кислоты. В итоге, в окончательной моче содержится только 3-10% от исходно профильтровавшегося количества мочевой кислоты. Гиперурикозурией считают мочевую экскрецию более 800 мг/сут у мужчин и более 750 мг/сут у женщин и связывают, главным образом, с нарушением реабсорбции мочевой кислоты [6].
Среди транспортеров, обеспечивающих реабсорбцию мочевой кислоты (URAT1, GLUT9, OAT4, OAT10), основное значение придают белку URAT1. Мутации, вызывающие полное отсутствие активности этого белка, приводят к практически полному прекращению реабсорбции мочевой кислоты. В этом случае экскретируемая фракция мочевой кислоты составляет 40-100%, а концентрация в крови в среднем снижается до кри тического уровня 0,93 мг/дл. Концентрации мочевой кислоты менее 1 мг/дл считают небезопасными и ассоциированными с риском нефролитиаза и острого почечного повреждения, вероятно, вследствие обструкции почечных канальцев преципитатами мочевой кислоты, спровоцированной физическими нагрузками. Среди причин острого почечного повреждения обсуждают также острую ишемию почек вследствие спазма почечных артерий, вызванного продукцией свободных перекисных радикалов. Наконец, повреждение почек может быть связано с избытком накопленных в цитоплазме тубулярного эпителия анионов, обладающих токсическими свойствами.
Активность URAT1 зависит от градиента натрия, создаваемого Na+K+АТФазой, так как этот градиент определяет количество анионов, которое должно быть обменено на мочевую кислоту. Активность транспортера находится также в прямой зависимости от уровня в крови тестостерона и в обратной зависимости от концентрации эстрогенов. По-видимому, этим механизмом опосредуется более высокий риск гиперурикемии у мужчин и женщин в постменопаузальном периоде. Этот белок рассматривают как основную мишень для разработки урикозурической терапии [6].
GLUT9 является менее значимым транспортером мочевой кислоты, однако он также, наряду с URAT1, ассоциирован с риском гиперурикозурии и уратного нефролитиаза и почечной недостаточностью вследствие физических перегрузок [6]. Важно отметить, что гиперурикозурия, вызванная дисфункцией этого транспортера, нередко сочетается с глюкозурией и возникает при значительном потреблении фруктозы (это может быть одним из объяснений уратного нефролитиаза при злоупотреблении продуктами, содержащими фруктозу).
У больных подагрой экскретируемая фракция мочевой кислоты снижается до 3-5%, что и позволяет рассматривать снижение почечной экскреции как основной фактор развития гиперурикемии. Снижение экскреции мочевой кислоты может быть итогом повреждения тубулярного эпителия вследствие длительной гиперурикозурии или быть вызвано изначальным снижением секреции мочевой кислоты. Основным транспортером, обеспечивающим тубулярную секрецию мочевой кислоты, является ABCG2. Мутации в гене этого белка четко ассоциированы с гиперурикемией и риском подагры [6].
Традиционное медикаментозное лечение подагры и гиперурикемии базируется на применении ингибиторов ксантиноксидазы, которые останавливают деградацию пуринов на этапе ксантина и, тем самым, блокируют образование мочевой кислоты. К таким препаратам относятся аллопуринол и фебуксостат. Основными показаниями к применению этих препаратов являются подагра, уратный нефролитиаз, а также состояния, сопровождающиеся гиперпродукцией мочевой кислоты – синдром Леша-Нихана, хронические миелопролиферативные заболевания (синдром лизиса опухоли). Наиболее широко применяют аллопуринол. Лечение рекомендуется начинать с дозы 100 мг/сут с последующим ее увеличением каждые 2-4 недели вплоть до 800 мг/сут, пока не будет достигнут целевой уровень мочевой кислоты менее 6 мг/сут. При этом следует помнить о необходимости избегать высокой дозы аллопуринола у больных с почечной недостаточностью.
Другим ингибитором ксантиноксидазы является фебуксостат, который применяют для лечения подагры (но не бессимптомной гиперурикемии) в дозах 40-80120 мг/сут при неэффективности или непереносимости аллопуринола. Выведение препарата преимущественно печенью позволяет использовать его у больных почечной недостаточностью. Фебуксостат слабо взаимодействует с другими медикаментами. Препарат особенно эффективен у больных с дисфункцией ABCG2-транспортера. В исследовании CARES частота сердечнососудистых событий при лечении фебуксостатом была несколько выше, чем при лечении аллопуринолом, хотя многие авторы указывают на ряд ограничений этого исследования [36-39].
В качестве второй линии терапии при неэффективности ингибиторов ксантиноксидазы используют урикозурические препараты – лезинурад, пробенецид и бензбромарон, которые блокируют реабсорбцию мочевой кислоты, подавляя активность URAT1. Увеличивая урикозурию, оба препарата могут провоцировать образование камней в системе мочевыделения, что требует эффективного защелачивания мочи.
В настоящее время проводится оценка и других препаратов, снижающих уровень мочевой кислоты, в частности препаратов уриказы и др.
Существенной проблемой в лечении больных подагрой является низкая приверженность больных к длительной терапии, как противовоспалительной, так и направленной на снижение уровня мочевой кислоты в крови. Многие пациенты продолжают нарушать гипопуриновую диету. Правильная организация работы с пациентом и проведение эффективных образовательных тренингов позволяют почти в 5 раз увеличить шансы достижения целевого уровня мочевой кислоты [40]. Способствует этому и проведение противовоспалительной терапии, в том числе применение колхицина и ингибиторов ИЛ-1 [41].
Плеер будет проигрывать видео в плейлисте после проигрывания выбранного видео
Код для встраивания видео
Настройки
Плеер автоматически запустится (при технической возможности), если находится в поле видимости на странице
Размер плеера будет автоматически подстроен под размеры блока на странице. Соотношение сторон — 16×9
Плеер будет проигрывать видео в плейлисте после проигрывания выбранного видео
При подагре в организме накапливается мочевая кислота, начинается отложение солей, появляется боль в суставах. Диета при подагре направлена на то, чтобы ограничить те продукты, которые повышают уровень мочевой кислоты. Ведущие рассказывают, какие продукты могут спровоцировать подагру, а какие, наоборот, от нее защищают.
Вместе с этим смотрят
Источники
- https://www.bsmu.by/page/6/5271/
- https://orto.lv/ru/novosti/nastupil-sezon-vspysek-podagry-kak-raspoznat-bolezn-17012017-241
- https://www.labquest.ru/analizy-i-tseny/biokhimicheskie-issledovaniya/biokhimicheskie-issledovaniya-krovi/substraty/mochevaya-kislota/
- https://clinpharm-journal.ru/articles/2019-2/kontseptsiya-autovospaleniya-v-geneze-podagry-i-giperurikemii/
- https://www.1tv.ru/shows/zhit-zdorovo/syuzhety/eda-i-bolezni-podagra-zhit-zdorovo-fragment-vypuska-ot-26-11-2019